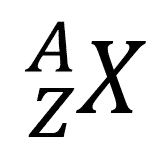Pengertian Inti Atom
Daftar Isi Artikel
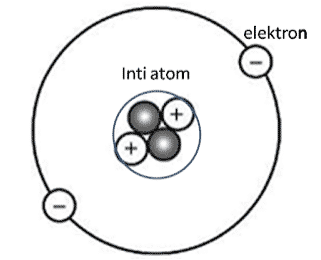
Inti atom adalah pusat atom yang terdiri dari proton dan neutron, dikelilingi oleh Awan elektron.[1] Banyaknya proton dalam inti atom disebut nomor atom, dan menentukan elemen dari suatu atom.
Pada dinamika kuantum, inti atom dapat digambarkan sebagai molekul yang seharusnya dibentuk oleh atom pengikat seperti yang dijelaskan oleh fisika molekul. Ukuran inti atom jauh lebih kecil dari ukuran atom itu sendiri, dan hampir sebagian besar tersusun dari proton dan neutron, hampir sama sekali tidak ada sumbangan dari elektron.
Jumlah netron dalam inti atom menentukan isotop elemen tersebut. Jumlah proton dan netron dalam inti atom saling berhubungan; biasanya dalam jumlah yang sama, dalam nukleus besar ada beberapa netron lebih. Kedua jumlah tersebut menentukan jenis nukleus.
Proton dan netron memiliki masa yang hampir sama, dan jumlah dari kedua masa tersebut disebut nomor massa, dan beratnya hampir sama dengan massa atom (tiap isotop memiliki masa yang unik). Masa dari elektron sangat kecil dan tidak menyumbang banyak kepada masa atom.
Inti Atom
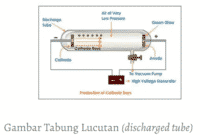
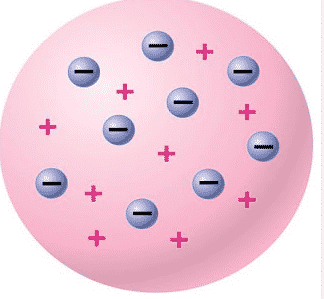
Konsep adanya inti atom pertama kali dinyatakan oleh Rutherford dari hasil serangkaian eksperimennya untuk menguji model atom yang dikemukakan oleh Thomson dengan percobaan yang terkenal dengan nama hamburan Rutherford. Dari eksperimen ini Rutherford menyimpulkan bahwa massa seluruh atom terkumpul pada suatu titik yang disebut inti atom yang bermuatan positif.
Muatan positif yang terdapat pada inti atom sama dengan jumlah muatan elektron yang bergerak mengelilingi inti. Partikel yang bermuatan positif dalam inti atom disebut proton. Kemudian ditemukannya neutron oleh James Chadwich yang juga merupakan partikel yang ada dalam inti atom tetapi tidak bermuatan (netral).
Dengan demikian inti atom tersusun oleh dua partikel yaitu proton dan neutron, proton bermuatan positif sedangkan neutron netral yang selanjutnya proton dan neutron ini disebut nukleon atau nuklida. Massa neutron hampir sama dengan proton, hanya saja massa neutron lebih besar sedikit dibandingkan massa proton.
Ukuran inti atom berkisar pada 10-15 m, sehingga massa partikelnya sangat kecil. Satuan massa untuk inti atom dipakai satuan massa atom yang disingkat sma di mana 1 sma = 1,6604 × 10-27 kg.
Inti atom dilambangkan
ZXA ………………………………..(10.1)
dengan X = namainti atom,
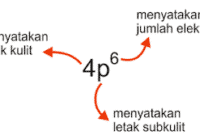
Z = nomor atom, menyatakan jumlah proton dalam inti atom atau jumlah elektron yang mengelilingi inti
A = N + Znomor massa atom, menyatakan jumlah proton dan neutron yang terdapat pada inti atom
Teori Atom
Atom merupakan bagian terkecil dari suatu materi. Atom berasal dari bahasa Yunani, yaitu atomos (a berarti tidak tomos berarti terbagi). Istilah atom telah digambarkan oleh Democritus beberapa abad sebelum Masehi. Gagasan yang bersifat ilmiah tentang atom pertama kali dikemukakan oleh John Dalton (1766-1844). John Dalton menyatakan bahwa setiap materi terdiri atas partikel-partikel terkecil yang sudah tidak terbagi lagi.
- Setiap unsur tersusun atas partikel-partikel terkecil yang sudah tidak terbagi lagi yang disebut atom;
- Atom-atom suatu unsur adalah identik (sama dalam segala hal), tetapi berbeda dari atom unsur lain;
- Suatu atom tidak dapat dimusnahkan, tidak dapat diciptakan, dan tidak dapat diubah menjadi atom unsur lain;
- Suatu senyawa merupakan hasil penggabungan atom unsur-unsur penyusunnya.
- Reaksi kimia adalah penggabungan atau pemisahan (reorganisasi) dari beberapa atom tertenu.
Dalam pernyataan tersebut, penulis akan menyampaikan komentar terhadap teori atom Dalton tersebut. Perlu diingat! John Dalton mengemukakan bahwa atom tidak dapat dimusnahkan, diciptakan, tidak dapat diubah. Para Ilmuwan abad pertengahan pernah bertanya “Bagaimana cara menjadikan besi menjadi emas?” ini yang dinamakan “Al-Kimia”.
Menurut teori yang dikemukakan oleh Dalton, atom adalah partikel terkecil suatu unsur. Atom emas dengan atom emas lain sama dalam segala hal (identik) tetapi berbeda dari atom unsur besi, atau atom unsur tembaga.
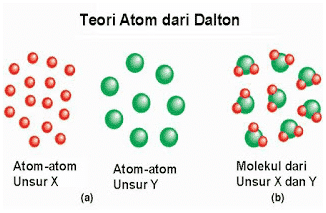
- Berdasarkan teori atom Dalton, atom-atom dari unsur yang sama itu identik. Atom-atom unsur X berbeda dengan atom-atom unsur Y.
- Molekul senyawa dihasilkan dari penggabungan atom unsur X dan Y dengan perbandingan 2 : 1.
Postulat Dalton menggambarkan bahwa atom merupakan bola pejal seperti bola tolak peluru yang sangat kecil. Pendapat atom ini kemudian disempurnakan oleh ahli-ahli yang lain, seperti J.J Thomson, Ruhterford, Niels Bohr, Schrodinger-Heisenberg.
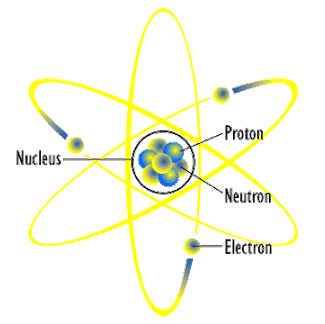

A = nomor massa
X = lambang unsur
Z = nomor atom
Dalam atom terdapat tiga istilah penting lainnya yaitu,
- Isotop, adalah atom-atom yang unsurnya sama, mempunyai nomor atom yang sama tetapi memiliki nomor massa berbeda.
- Isobar, adalah atom dari unsur yang berbeda, mempunyai nomor atom berbeda tetapi mempunyai nomor massa yang sama.
- Isoton, adalah atom dari unsur yang berbeda, mempunyai nomor atom berbeda tetapi mempunyai jumlah neutron yang sama.