Perkembangan Pemahaman Mengenai Struktur Atom
Daftar Isi Artikel
- John Dalton (1766-1844) dari Inggris mengemukakan “ Materi tersusun dari atom- atom”
- Sir Humphry Davy (1778-1829) dan Michael Faraday (1791-1867)
- Menemukan metode elektolisis yaitu cara menguraikan senyawa menjadi unsur-unsurnya dengan bantuan arus listrik maka didapat “ atom mengandung muatan listrik”
- Henrick Geisser(1829-1879) dari Jerman dan Julius Plucker (1801-1868) menemukan “ sinar katoda “
- William crookes (1832-1919) dari Inggris mengemukakan “sinar katoda merupakan kumpulan partikel-partikel yang saat ini belum dikenal.”
- George Johnstone Stoney(1817-1895) di tahun 1891 partikel sinar katoda dengan “elektron”
- Antone Henry Bequerel (1852-1908)dari Prancis “uranium dan senyawa-senyawanya secara spontan memancarkan partikel-partikel.” Kemudian disebut sinar alfa (+), sinar beta(-), dan sinar gamma (tidak bermuatan).
- Joseph John Thomson (1856 – 1940), dari Inggris “ elektron merupakan partikel penyusun atom” dan Thomson mampu menghitung perbandingan muatan terhadap massa electron (e/m) yaitu 1,759 x 108 coulomb/gram.
- Robert Andrew Milikan (1868-1953), dari Universitas Chicago tahun 1980 menemukan harga muatan electron 1,602 x 10-19 coulomb.
Eugen Goldstein (1850-1930),Tahun 1886 mengisyaratkan adanya partikel muatan positif yang dikandung oleh atom.
Ernest Rutherford (1871-1937) ,Tahun 1906 menghitung massa partikel bermuatan positif 1837 kali massa elektron yang dinamai dengan proton.
Massa satu electron = 9,11 x 10-28 gram
Massa satu proton = 1837 x 9,11 x 10-28 gram
= 1,673 x 10-34 gram
Oleh karena itu suatu atom bersifat netral maka jumlah proton dalam atom harus sama dengan jumlah elektron.
– Hans Geiger dan Ernest Marsden dan Rutherford (1908) menyimpulkan :
- Atom mengandung inti atom yang sangat kecil dan luar biasa kepadatannya. Dalam inti atom terkumpul proton. Pembelokan atau pemantulan kembali sinar alfa disebabkan oleh tabrakan antara sinar alfa dan inti atom.
- Oleh karena sebagian besar sinar alfa tidak dibelokkan berarti sebagian besar volume atom merupakan ruang kosong tersebut. Sinar alfa tidak dipengaruhi electron sebab massa electron sangat kecil.
- Untuk mengimbangi gaya tarik inti (yang bermuatan positif karena mengandung proton), elektron-elektron (yang bermuatan negatif) harus beredar mengelililngi inti atom, seperti planet-planet mengelilingi matahari.
Teori Atom Modern Rutheford
- Atom tersusun dari :
- inti atom yang bermuatan positif
- elektron-elektron yang bermuatan negatif dan mengelilingi inti.
- Semua proton terkumpul dalam inti atom dan menyebabkan inti atom bermuatan positif.
- Sebagian besar volume atom merupakan ruang kosong. Hampir semua massa atom terpusat pada inti atom yang sangat kecil. Jari-jari atom sekitar 10-10meter, sedangkan jari-jari inti atom sekitar 10-15 meter.
- Jumlah proton dalam inti sama dengan jumlah elektron yang mengelilingi inti, sehingga atom bersifat netral.
James Chadwick (1891-1974) ,Tahun 1932 menemukan netron yaitu partikel muatan inti yang tidak bermuatan.
Jadi , inti atom tersusun :
- proton, yaitu partikel bermuatan positif
- neutron, yaitu partikel yang tidak bermuatan
Proton dan neutron diseburt nukleon-nukleon.
Partikel-partikel Penyusun Atom
- Nomor Atom Dan Massa Atom
Henry Gwin Jeffrey Moseley (1887-1915)
Tahun 1913 menemukan jumlah muatan positif dalam inti atom merupakan sifat khas masing-masing unsur. Atom–atom dari unsur yang sama punya jumlah muatan positif (proton) yang sama.
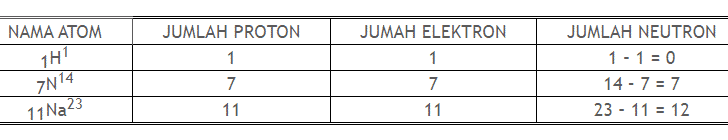
Nomor atom (Z) = jumlah proton
= jumlah elektron
Massa atom (A) = jumlah proton + neutron
Jumlah neutron = A – Z
zXA
contoh :
- Konfigurasi Elektron
Konfigurasi electron adalah susunan elektorn-elektron didalam suatu atom sesuai dengan tingkat energinya masing-masing.
Model atom Rutherford –Bohrn:
Elekton –elektron didalam atom tersusun menurut tingkat energinya.
Elektron-elektron dengan tingkat energi rendah tempat kedudukanya dekat dengan inti atom. Sebaliknya electron dengan tingkat energi lebih tinggi tempat kedudukannya lebih jauh dari inti atom.
Elektron-elektron mulai mengisi pada tingkat energi atau kulit yang paling rendah baru setelah penuh , electron mulai mengisi tingkat energi tinggi/kulit selanjutnya.
Tingkat energi ke 1,2,3,4,5,6,7 dan masing-masing disebut kulit K,L,M,N,O,P,Q.
Banyaknya elektron maksimum yang dapat menempati tiap tingkat energi /kulit sesuai :
2n2
dengan n = tingkat energi/kulit ke-n
- Elektron Valensi
Elektron valensi atau tingkat valensi elektron satu atau lebih yang terdapat pada tingkat energi tertinggi (kulit terluar) yang dimiliki suatu atom.
Elektron valensi berperan pada ikatan antar atom.
Unsur-unsur punya jumlah elektron valensi sama memiliki sifat kimia sama.
Contoh :
3Li = 2, 1 artinya : Li , golongan IA dan periode 2
11Na= 2, 8, 1 artinya : Na, golongan IA dan periode 3
19K = 2, 8 , 8, 1 artinya K , golongan IA dan periode 4
35Br= 2, 8, 18, 7 artinya : Br, golongan VIIA dan periode 4
13Al = 2, 8, 3 artinya Al, golongan IIIA dan periode 3
PENEMUAN PARTIKEL SUBATOMIK: ELEKTRON
Setelah John Dalton (1766-1844) pada tahun 1803 mengemukakan teori atom yang pertama kali, maka tidak lama setelah itu dua orang ilmuwan yaitu Sir Humphry Davy (1778-1829) dan muridnya Michael Faraday (1791-1867), menemukan metode elektrolisis, yaitu cara menguraikan senyawa menjadi unsur-unsurnya dengan bantuan arus listrik. Dengan metode baru itulah akhirnya mereka menemukan bahwa atom mengandung muatan listrik.
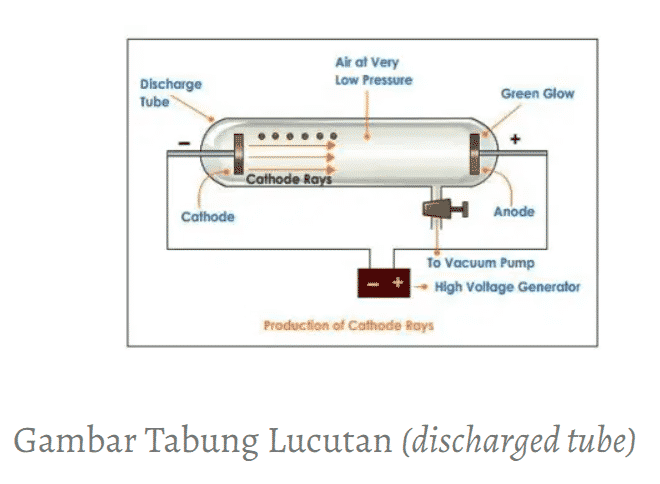
Sejak pertengahan abad ke-19, para ilmuwan banyak meneliti daya hantar listrik dari gas-gas pada tekanan rendah. Tabung lampu gas pertama kali dirancang oleh Heinrich Geissler (1829-1879) dari Jerman pada tahun 1854.
Rekannya, Julius Plucker (1801-1868), membuat eksperimen sebagai berikut. Dua pelat logam ditempatkan pada masing-masing tabung Geissler yang divakumkan, lalu tabung gelas itu diisi dengan gas pada tekanan rendah.
Salah satu pelat logam (disebut anode) membawa muatan positif, dan pelat yang satu lagi (disebut katode) membawa muatan negatif. Ketika muatan listrik bertegangan tinggi dialirkan melalui gas dalam tabung, muncullah nyala berupa sinar dari katode ke anode. Sinar yang dihasilkan ini disebut sinar katode.
Sifat sinar katode, antara lain :
- merambat tegak lurus dari permukaan katode menuju anode;
- merupakan radiasi partikel sehingga terbukti dapat memutar baling-baling;
- bermuatan listrik negatif sehingga dibelokkan ke kutub listrik positif;
- dapat memendarkan berbagai jenis zat, termasuk gelas.
Plucker ternyata kurang teliti dalam pengamatannya dan menganggap sinar tersebut hanyalah cahaya listrik biasa. Pada tahun 1875, William Crookes (1832-1919) dari Inggris, mengulangi eksperimen Plucker tersebut dengan lebih teliti dan mengungkapkan bahwa sinar katode merupakan kumpulan partikel-partikel yang saat itu belum dikenal.
Hasil-hasil eksperimen Crookes dapat dirangkum sebagai berikut.
- Partikel sinar katode bermuatan negatif sebab tertarik oleh pelat yang bermuatan positif.
- Partikel sinar katode mempunyai massa sebab mampu memutar baling-baling dalam tabung.
- Partikel sinar katode dimiliki oleh semua materi sebab semua bahan yang digunakan (padat, cair, dan gas) menghasilkan sinar katode yang sama. Partikel sinar katode itu dinamai “elektron” oleh George Johnstone Stoney (1817 – 1895) pada tahun 1891.
Pada masa itu para ilmuwan masih diliputi kebingungan dan ketidaktahuan serta ketidakpercayaan bahwa setiap materi memiliki elektron karena mereka masih percaya bahwa atom adalah partikel terkecil penyusun suatu materi. Kalau atom merupakan partikel terkecil, maka di manakah keberadaan elektron dalam materi tersebut?
Pada tahun 1897, Joseph John Thomson (1856 – 1940) dari Inggris melalui serangkaian eksperimennya berhasil mendeteksi atau menemukan elektron yang dimaksud Stoney. Thomson membuktikan bahwa elektron merupakan partikel penyusun atom, bahkan Thomson mampu menghitung perbandingan muatan terhadap massa elektron (e/m), yaitu 1,759 x 108 coulomb/gram.
Kemudian pada tahun 1908, Robert Andrew Millikan (1868-1953) dari Universitas Chicago menemukan harga muatan elektron, yaitu 1,602 x 10-19 coulomb. Dengan demikian massa sebuah elektron dapat dihitung.
Massa satu elektron = e/(e/m) = (1,602 x 10-19) / (1,759 x 108) = 9,11 × 10–28 gram
Pernahkah Anda memperhatikan tabung televisi? Tabung televisi merupakan tabung sinar katode. Percobaan tabung sinar katode pertama kali dilakukan oleh William Crookes (1875). Hasil eksperimennya yaitu ditemukannya seberkas sinar yang muncul dari arah katode menuju ke anode yang disebut sinar katode.
George Johnstone Stoney (1891) yang mengusulkan nama sinar katode disebut “elektron”. Kelemahan dari Stoney tidak dapat menjelaskan pengaruh elektron terhadap perbedaan sifat antara atom suatu unsur dengan atom dalam unsur lainnya. Antoine Henri Becquerel (1896) menentukan sinar yang dipancarkan dari unsur-unsur radioaktif yang sifatnya mirip dengan elektron.
Joseph John Thomson (1897) melanjutkan eksperimen William Crookes yaitu pengaruh medan listrik dan medan magnet dalam tabung sinar katode.