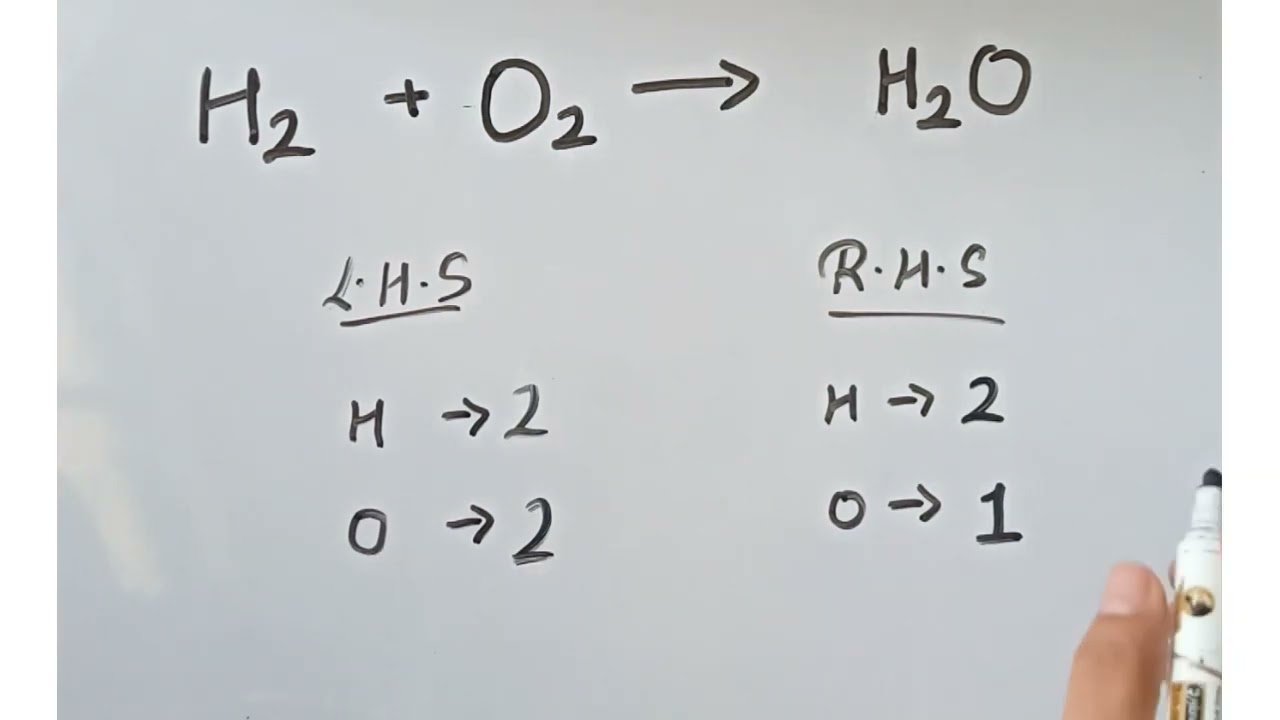H₂ + O₂ → H₂O adalah salah satu persamaan reaksi kimia paling mendasar dan sering dibahas di pelajaran Kimia SMP hingga SMA. Reaksi ini tidak hanya menjadi contoh ideal untuk mempelajari hukum kekekalan massa dan stoikiometri, tapi juga memiliki makna besar di kehidupan nyata karena menghasilkan air (H₂O) zat vital bagi seluruh makhluk hidup di bumi. Bagaimana persamaan ini terjadi, apa artinya, dan bagaimana penerapannya dalam berbagai bidang? Berikut ulasan lengkap dan update-nya di tahun 2025.
Pengertian dan Penjelasan Reaksi H₂ + O₂ → H₂O
Persamaan reaksi kimia H₂ + O₂ → H₂O menunjukkan proses antara gas hidrogen (H₂) dan gas oksigen (O₂) yang membentuk air (H₂O). Reaksi ini termasuk reaksi pembentukan, di mana dua unsur berbeda bergabung menjadi satu senyawa.
Rumus Kimia:
- H₂ = Gas Hidrogen (dua atom hidrogen)
- O₂ = Gas Oksigen (dua atom oksigen)
- H₂O = Air (satu molekul terdiri dari dua atom hidrogen dan satu atom oksigen)
Persamaan Kimia Belum Setara:
Jika ditulis sederhana:
mathematicaCopyEditH₂ + O₂ → H₂O
Tapi, persamaan reaksi kimia ini belum setara (tidak memenuhi hukum kekekalan massa) karena jumlah atom di kiri dan kanan tanda panah belum sama.
Menyetarakan Persamaan Reaksi H₂ + O₂ → H₂O
Agar memenuhi hukum Lavoisier (kekekalan massa), persamaan reaksi harus setara jumlah atomnya:
- Hitung jumlah atom di kiri dan kanan:
- Kiri: H = 2, O = 2
- Kanan: H = 2, O = 1
- Samakan jumlah atom O di kanan jadi 2:
Untuk itu, H₂O dikalikan 2: mathematicaCopyEditH₂ + O₂ → 2 H₂O - Cek jumlah atom H di kanan:
2 H₂O = 2 × 2 atom H = 4 atom H- Kiri: H₂ = 2 atom H → harus dikali 2:
2 H₂ + O₂ → 2 H₂O - Cek akhir:
- Kiri: H = 4, O = 2
- Kanan: H = 4, O = 2
Persamaan kini sudah setara!
Persamaan Setara:
mathematicaCopyEdit2 H₂ + O₂ → 2 H₂O
Persamaan Reaksi Kimia: Stoikiometri Reaksi H₂ + O₂ → H₂O
Stoikiometri adalah ilmu yang mempelajari hubungan kuantitatif antara reaktan dan produk dalam persamaan reaksi kimia. Pada reaksi ini, berlaku perbandingan mol:
- 2 mol H₂ bereaksi dengan 1 mol O₂ menghasilkan 2 mol H₂O
Perbandingan Mol
| Reaktan | Mol | Produk | Mol |
|---|---|---|---|
| H₂ | 2 | H₂O | 2 |
| O₂ | 1 |
Contoh Soal Stoikiometri
Soal 1:
Jika tersedia 10 mol H₂ dan oksigen berlebih, berapa mol H₂O yang bisa terbentuk?
Jawaban:
2 mol H₂ menghasilkan 2 mol H₂O
Jadi, 10 mol H₂ menghasilkan = (10/2) × 2 = 10 mol H₂O
Soal 2:
Jika ada 5 mol O₂ dan hidrogen berlebih, berapa mol H₂O yang terbentuk?
Jawaban:
1 mol O₂ menghasilkan 2 mol H₂O
Jadi, 5 mol O₂ menghasilkan = 5 × 2 = 10 mol H₂O
Persamaan Reaksi Kimia: Hukum Lavoisier pada Reaksi H₂ + O₂ → H₂O
Reaksi ini juga membuktikan Hukum Kekekalan Massa:
“Massa zat sebelum reaksi sama dengan massa zat sesudah reaksi.”
Contoh:
- 4 gram H₂ + 32 gram O₂ → 36 gram H₂O
Manfaat dan Penerapan Reaksi H₂ + O₂ → H₂O dalam Kehidupan
1. Pembentukan Air
Air merupakan hasil reaksi hidrogen dan oksigen, baik di alam (misal reaksi di atmosfer) maupun rekayasa laboratorium/industri. Air adalah zat utama bagi kehidupan, pertanian, industri, dan teknologi modern.
2. Teknologi Fuel Cell (Sel Bahan Bakar Hidrogen)
Reaksi H₂ + O₂ → H₂O adalah dasar teknologi fuel cell:
- Sel bahan bakar mengubah hidrogen dan oksigen menjadi listrik dengan hasil samping hanya air (ramah lingkungan).
- Banyak kendaraan listrik generasi terbaru (mobil, kapal, pesawat) mulai menggunakan fuel cell berbasis reaksi ini.
3. Persamaan reaksi kimia: Eksplorasi Luar Angkasa
Astronot menggunakan reaksi ini untuk menghasilkan air di luar angkasa hidrogen dan oksigen dari elektrolisis air atau bahan bakar roket bisa direkombinasi membentuk air minum.
4. Industri Kimia
Reaksi ini juga digunakan untuk menguji kemurnian gas hidrogen, oksigen, dan dalam proses pembuatan senyawa lain.
Bahaya Reaksi H₂ + O₂ → H₂O
- Eksotermik: Reaksi ini sangat eksotermik (melepaskan energi panas tinggi), sehingga dalam skala besar bisa menimbulkan ledakan (misal, kecelakaan Zeppelin Hindenburg 1937).
- Penggunaan harus terkontrol di laboratorium maupun industri.
Tabel Ringkasan Reaksi H₂ + O₂ → H₂O
| Reaktan | Produk | Persamaan Setara | Perbandingan Mol | Tipe Reaksi |
|---|---|---|---|---|
| Hidrogen (H₂) | Air (H₂O) | 2 H₂ + O₂ → 2 H₂O | 2:1:2 | Pembentukan |
| Oksigen (O₂) | Eksotermik |
FAQ Reaksi H₂ + O₂ → H₂O
Q: Mengapa persamaan harus disetarakan?
A: Agar sesuai hukum kekekalan massa; jumlah atom setiap unsur sama di kedua sisi.
Q: Apakah reaksi ini bisa terjadi spontan di udara?
A: Tidak, butuh energi awal (misal: percikan api); setelah itu reaksi berlangsung sangat cepat.
Q: Mengapa reaksi ini penting di fuel cell?
A: Karena menghasilkan energi bersih tanpa polusi—produk sampingnya hanya air.
Persamaan reaksi kimia 2 H₂ + O₂ → 2 H₂O adalah dasar bagi banyak proses kehidupan dan teknologi masa depan. Dengan memahami persamaan reaksi, konsep stoikiometri, dan aplikasinya, kita dapat lebih mengapresiasi peran air serta pentingnya sains di berbagai aspek kehidupan. Reaksi ini juga menjadi pionir inovasi energi bersih di era transisi menuju teknologi ramah lingkungan tahun 2025.