Benzena (C₆H₆) adalah senyawa aromatik sederhana yang menjadi bahan dasar penting dalam kimia organik dan industri petrokimia. Salah satu topik menarik yang sering ditanyakan dalam dunia pendidikan dan riset adalah tentang reaksi adisi benzena. Apa itu reaksi adisi pada benzena? Bagaimana mekanismenya, dan apa saja contoh serta aplikasi reaksinya dalam kehidupan sehari-hari? Berikut ulasan lengkap dan update tahun 2025, yang akan memperkaya pemahaman Anda tentang dunia aromatik.
Mengenal Struktur Benzena
Benzena memiliki struktur cincin segi enam dengan tiga ikatan rangkap bergantian, yang dalam kenyataannya bersifat resonansi artinya keenam atom karbon membentuk struktur planar dengan kepadatan elektron merata di seluruh cincin. Struktur unik ini membuat benzena sangat stabil dibandingkan alkena biasa, sehingga sifat reaktifnya pun berbeda.
Apa Itu Reaksi Adisi pada Benzena?
Reaksi adisi Benzena secara umum adalah reaksi penambahan atom atau gugus ke molekul tak jenuh (seperti alkena atau alkuna), sehingga ikatan rangkapnya berkurang atau hilang.
Namun, benzena sangat enggan mengalami reaksi adisi. Ini karena cincin aromatik benzena sangat stabil akibat delokalisasi elektron π (pi). Reaksi adisi akan merusak kestabilan aromatik ini, sehingga sangat sulit terjadi kecuali di bawah kondisi ekstrem atau dengan pereaksi sangat reaktif.
Mekanisme Umum Reaksi Adisi Benzena
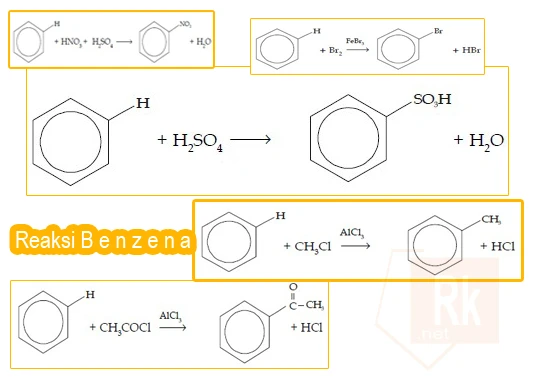
Kebanyakan senyawa aromatik, termasuk benzena, lebih mudah mengalami reaksi substitusi elektrofilik (seperti nitrasi, sulfonasi, halogenasi), daripada adisi. Hal ini bertujuan agar sistem aromatiknya tetap utuh.
Reaksi adisi pada benzena biasanya hanya terjadi jika:
- Digunakan katalisator khusus (misal: logam pada reaksi hidrogenasi)
- Kondisi suhu dan tekanan sangat tinggi
- Menggunakan zat pengoksidasi atau pereduksi sangat kuat
Contoh Reaksi Adisi Benzena
1. Adisi Hidrogen (Hidrogenasi Benzena)
Ini adalah contoh klasik reaksi adisi pada benzena. Benzena dapat diubah menjadi sikloheksana melalui adisi hidrogen:
Persamaan reaksi:
mathematicaCopyEditC₆H₆ + 3 H₂ ⟶ C₆H₁₂
Dengan katalis nikel (Ni), platinum (Pt), atau paladium (Pd), serta suhu dan tekanan tinggi.
Penjelasan:
- Setiap molekul benzena (C₆H₆) menyerap 3 molekul hidrogen (H₂)
- Proses ini memutus semua ikatan π, sehingga membentuk cincin jenuh sikloheksana (C₆H₁₂)
- Struktur aromatik hilang, sifat kimia berubah
2. Adisi Halogen (Reaksi Sangat Jarang)
Secara teori, benzena bisa mengalami adisi halogen (misal: Cl₂ atau Br₂) membentuk heksaklorosikloheksana (C₆H₆Cl₆), namun reaksi ini hanya terjadi di bawah sinar UV, tekanan tinggi, dan biasanya merusak cincin aromatik.
Persamaan reaksi:
mathematicaCopyEditC₆H₆ + 3 Cl₂ ⟶ C₆H₆Cl₆
Proses ini lebih dikenal sebagai reaksi klorinasi total, bukan reaksi umum dalam laboratorium biasa.
Perbedaan Reaksi Adisi dan Substitusi pada Benzena
| Sifat | Reaksi Adisi | Reaksi Substitusi |
|---|---|---|
| Terjadi pada | Benzena dan alkena/alkuna | Benzena dan senyawa aromatik |
| Contoh utama | Hidrogenasi, klorinasi | Nitrasi, sulfonasi, halogenasi |
| Kondisi | Syarat ekstrem, katalis kuat | Kondisi lembut, katalis asam/FeCl₃ |
| Akibat pada cincin | Merusak aromatik, hilang | Aromatik tetap terjaga |
| Reaktivitas benzena | Sangat rendah (sulit) | Sangat tinggi (mudah terjadi) |
Aplikasi Industri dari Reaksi Adisi Benzena
a. Industri Plastik dan Polimer
Sikloheksana hasil adisi hidrogen dari benzena adalah bahan baku utama untuk pembuatan nilon (melalui sikloheksanon atau asam adipat). Industri tekstil dan plastik dunia sangat bergantung pada reaksi ini.
b. Produksi Insektisida
Heksaklorosikloheksana (HCH) yang dihasilkan melalui adisi klorin pada benzena, pernah digunakan sebagai insektisida (Lindane), meskipun sekarang penggunaannya terbatas karena isu toksisitas.
c. Hidrogenasi pada Pembuatan Pelarut
Sikloheksana digunakan sebagai pelarut di industri cat, pestisida, dan farmasi.
Kenapa Reaksi Adisi Benzena Sulit Terjadi?
Stabilitas sistem aromatik benzena sangat tinggi. Energi yang diperlukan untuk memutus delokalisasi elektron π jauh lebih besar daripada keuntungan yang diperoleh dari adisi. Oleh karena itu, dalam kimia organik, adisi pada benzena hanya dilakukan jika benar-benar diperlukan dan dengan teknologi tinggi.
Tabel Ringkasan Reaksi Adisi Benzena
| Reaksi Adisi | Reaktan | Produk | Katalis/Kondisi |
|---|---|---|---|
| Hidrogenasi | Benzena + 3 H₂ | Sikloheksana | Ni, Pt, Pd, suhu & tekanan tinggi |
| Klorinasi total | Benzena + 3 Cl₂ | Heksaklorosikloheksana | Sinar UV, suhu tinggi |
Fakta Terbaru (Update 2025) Tentang Benzena dan Reaksi Adisinya
- Industri kimia hijau kini mengembangkan katalis baru yang memungkinkan adisi benzena berlangsung lebih efisien dan ramah lingkungan.
- Penelitian terbaru fokus pada upaya memanfaatkan limbah benzena dengan cara hidrogenasi, demi mengurangi pencemaran aromatik di lingkungan.
- Penggunaan sikloheksana sebagai bahan baku polimer diprediksi meningkat seiring tren tekstil berbasis bio-material.
Reaksi adisi benzena merupakan proses penambahan atom ke cincin aromatik, namun sangat sulit terjadi karena kestabilan struktur benzena yang tinggi. Reaksi adisi utama yang relevan secara industri adalah hidrogenasi menjadi sikloheksana, serta klorinasi ekstrem menjadi heksaklorosikloheksana. Meski jarang, reaksi adisi benzena sangat penting dalam industri polimer, pelarut, dan pengembangan bahan kimia modern. Pemahaman tentang reaksi adisi benzena memperkaya wawasan kita tentang sifat kimia aromatik dan aplikasi terbarunya di dunia teknologi dan lingkungan.