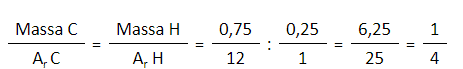Rumus Empiris dan Rumus Molekul
Daftar Isi Artikel
Jenis-Jenis Rumus Kimia
Dalam menyatakan rumus kimia dari suatu senyawa dinyatakan dengan lambang dan jumlah atom unsur penyusun senyawa tersebut tanpa menyebut senyawa tersebut termasuk senyawa ionik atau kovalen.
Terdapat dua cara dalam menyatakan rumus kimia dari suatu senyawa, yaitu rumus empiris dan rumus molekul.
- Rumus Empiris
Rumus empiris adalah rumus yang menyatakan perbandingan jumlah atom unsur yang membentuk suatu senyawa. Rumus empiris dari suatu senyawa dicari perbandingan mol yang paling sederhana atau bisa dikatakan perbandingan mol yang tidak dapat disederhanakan lagi. - Rumus Molekul
Rumus Molekul adalah rumus menyatakan jumlah atom unsur yang sesungguhnya dari suatu senyawa. Rumus molekul menyatakan n kelipatan dari rumus empiris.
Contoh Rumus Empiris
Perhatikan contoh berikut ini agar anda mendapatkan gambaran seperti apa yang dinamakan rumus empiris.
- Senyawa Natrium Klorida dilambangkan dengan rumus kimia NaCl
NaCl terdiri dari : 1 atom Natrium dan 1 atom Klorin
Perbandingan jumlah atom dari masing-masing unsur adalah Na : Cl = 1 : 1. Perbandingan ini tidak dapat disederhankan lagi
Dengan demikian rumus empirisnya adalah : NaCl - Senyawa Kalsium klorida dilambangkan dengan rumus kimia CaCl2
CaCl2 terdiri dari : 1 atom Kalsium dan 2 atom Klorin.
Perbandingan jumlah atom dari masing-masing unsur adalah Ca : Cl = 1 : 2. Perbandingan ini tidak dapat disederhankan lagi
Dengan demikian rumus empirisnya adalah : CaCl2 - Senyawa Asam Karbonat dilambangkan dengan rumus kimia C6H8O6
C6H8O6 terdiri dari : 6 atom Karbon, 8 atom Hidrogen dan 6 atom Oksigen.
Perbandingan jumlah atom dari masing-masing unsur adalah C : H : O = 6 : 8 : 6. Perbandingan ini dapat disederhnakan lagi, yaitu kita bagi dengan dua (/2) sehingga kita dapatkan perbandingan baru :
C : H : O = 3 : 4 : 3. Disini perbandingannya sudah tidak dapat disederhanakan lagi.
Dengan demikian rumus empirisnya adalah : C3H4O3
Contoh Rumus Molekul
Perhatikan contoh rumus molekul dibawah ini agar anda dapat memahami dengan baik tentang rumus molekul.
- Senyawa Etena dilambangkan dengan rumus kimia C2H4
C2H4 terdiri dari : 2 atom Karbon dan 4 atom Hidrogen.
Perbandingan jumlah atom dari masing-masing unsur adalah C : H = 2 : 4.
Perbandingan ini masih bisa disederhankan lagi yaitu dengan membagi dengan 2 (/2). Sehingga didapatkan perbandingan barunya adalah C : H = 1 : 2
Dengan demikian rumus empirisnya adalah : CH2 - Senyawa Pentena dilambangkan dengan rumus kimia C5H10
C5H10 terdiri dari : 5 atom Karbon dan 10 atom Hidrogen.
Perbandingan jumlah atom dari masing-masing unsur adalah C : H = 5 : 10.
Perbandingan ini masih bisa disederhankan lagi yaitu dengan membagi dengan 2 (/2). Sehingga didapatkan perbandingan barunya adalah C : H = 1 : 2
Dengan demikian rumus empirisnya adalah : CH2
Perhatikan bahwa molekul C2H4 dan C5H10 memiliki rumus empiris yang sama. Akan tetapi pada dasarnya kedua molekul tersebut adalah senyawa yang berbeda.
Cara Menentukan Rumus Empiris
Berikut ini adalah tahapan-tahapan yang perlu anda ikuti dalam mencari atau menentukan rumus empiris dari suatu senyawa :
- Menentukan massa masing-masing unsur dari suatu senyawa.
Jika massanya berbentuk persentase, kita asumsikan bahwa total massa dari senyawa tersebut adalah 100 gram. Sehingga baru bisa kita dapatkan massa masing-masing unsur. - Menentukan mol masing-masing unsur.
Nilai mol didapatkan dengan membagi massa dengan massa atom relatif (Ar) dari suatu unsur. - Membanding mol dari masing-masing unsur
Perbandingan mol yang paling sederhana dianggap sebagai rumus empiris.
- Menentukan perbandingan massa atom-atom penyusun senyawa, bila diketahui dalam bentuk persen maka harus diubah dalam bentuk pecahan.
- Mengubah perbandingan massa menjadi perbandingan mol, dengan membagi massa atom dengan Ar masing-masing.
- Perbandingan mol atom-atom tersebut merupakan rumus empiris senyawa.