Perkembangan ilmu pengetahuan tentang struktur atom merupakan salah satu tonggak penting dalam dunia sains. Salah satu teori yang paling berpengaruh dalam sejarah adalah model atom Rutherford, yang menjadi jembatan penting menuju pemahaman modern tentang susunan atom dan bagaimana partikel di dalamnya saling berinteraksi. Namun, apa sebenarnya ciri-ciri atom menurut Rutherford? Bagaimana model ini ditemukan, dan apa dampaknya hingga saat ini? Simak ulasan lengkap berikut ini.
Sejarah Singkat Model Atom Rutherford
Pada awal abad ke-20, ilmuwan asal Selandia Baru, Ernest Rutherford, bersama rekan-rekannya Hans Geiger dan Ernest Marsden, melakukan eksperimen fenomenal yang dikenal sebagai percobaan hamburan partikel alfa (Gold Foil Experiment) pada tahun 1909. Percobaan ini melibatkan penembakan partikel alfa ke arah lembaran tipis emas dan mengamati pola hamburannya.
Eksperimen ini menghasilkan temuan mengejutkan sebagian besar partikel alfa menembus lembaran emas tanpa membelok, namun sebagian kecil dipantulkan atau dibelokkan dengan sudut tajam. Fakta ini tidak bisa dijelaskan dengan model atom Thomson (model “roti kismis”). Dari sinilah Rutherford mengusulkan model atom baru yang kini dikenal sebagai model atom Rutherford.
Ciri-ciri Atom Rutherford
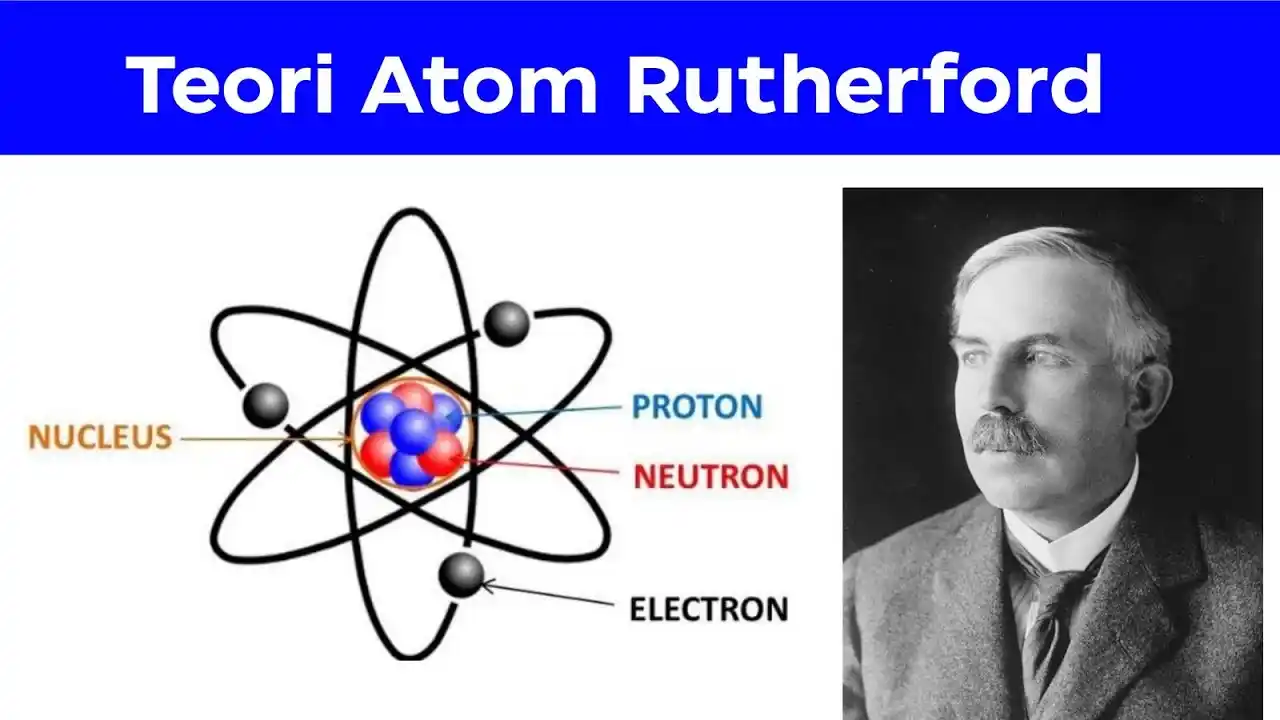
Atom Terdiri dari Inti (Nukleus) yang Sangat Kecil dan Padat
Ciri-ciri atom Rutherford adalah adanya inti atom (nukleus) yang sangat kecil, padat, dan bermuatan positif. Hampir seluruh massa atom terkonsentrasi pada inti ini.
Elektron Mengelilingi Inti pada Jarak Relatif Jauh
Elektron-elektron bermuatan negatif bergerak mengelilingi inti atom dengan lintasan tertentu, membentuk “awan” elektron di sekeliling nukleus. Jarak antara inti dan elektron sangat besar jika dibandingkan ukuran inti itu sendiri.
Atom Sebagian Besar Berisi Ruang Kosong
Menurut Rutherford, sebagian besar volume atom adalah ruang kosong. Hal ini menjelaskan mengapa sebagian besar partikel alfa dapat melewati lembaran emas tanpa mengalami pembelokan.
Muatan Positif Terkonsentrasi di Inti Atom
Inti atom Rutherford mengandung seluruh muatan positif atom, yang berasal dari proton (meski saat itu neutron belum ditemukan).
Tidak Ada Penjelasan Lintasan Elektron yang Stabil
Model Rutherford menggambarkan elektron bergerak mengelilingi inti layaknya planet mengelilingi matahari, namun belum mampu menjelaskan mengapa elektron tidak jatuh ke inti akibat gaya tarik elektromagnetik. Ini menjadi salah satu kelemahan model ini, yang kemudian disempurnakan oleh model Bohr.
Menjelaskan Hamburan Partikel Alfa
Model ini berhasil menjelaskan hasil percobaan hamburan partikel alfa: partikel alfa yang dekat dengan inti akan dibelokkan, sementara yang jauh dari inti tidak akan terpengaruh dan bergerak lurus menembus atom.
Penjelasan Ilmiah Setiap Ciri Model Atom Rutherford
Inti Atom (Nukleus)
Inti atom Rutherford berukuran sangat kecil (sekitar 1/10.000 dari diameter atom), tapi mengandung hampir seluruh massa atom. Inti bermuatan positif akibat keberadaan proton.
Elektron di Sekitar Inti
Elektron tidak berada di dalam inti, melainkan mengelilingi inti pada lintasan tertentu. Elektron ini menjaga atom tetap netral secara muatan listrik jika jumlah elektron = jumlah proton.
Ruang Kosong dalam Atom
Hasil percobaan Rutherford menegaskan bahwa struktur atom tidak padat sepenuhnya, tetapi lebih banyak mengandung ruang kosong, sehingga sebagian besar partikel alfa dapat melewati atom tanpa gangguan.
Kekuatan Gaya Listrik
Gaya tarik-menarik antara elektron dan inti menyebabkan elektron tetap berada di sekitar inti, tapi Rutherford tidak dapat menjelaskan kestabilan lintasan elektron menurut teori fisika klasik.
Kelebihan dan Kelemahan Model Atom Rutherford
Kelebihan
- Mampu menjelaskan fenomena hamburan partikel alfa.
- Memperkenalkan konsep inti atom, yang menjadi fondasi fisika nuklir.
- Membuka jalan untuk penelitian lebih lanjut tentang struktur atom dan partikel subatomik.
Kelemahan
- Tidak dapat menjelaskan kestabilan lintasan elektron.
- Tidak dapat menjelaskan spektrum garis atom hidrogen.
- Belum mengenal neutron (baru ditemukan oleh James Chadwick tahun 1932).
Tabel Ringkasan Ciri-ciri Model Atom Rutherford
| Ciri Model Rutherford | Penjelasan Singkat |
|---|---|
| Ada inti atom | Inti sangat kecil, bermuatan positif, massa atom terkonsentrasi di inti. |
| Elektron mengelilingi inti | Elektron bermuatan negatif, bergerak di sekitar inti. |
| Atom sebagian besar kosong | Volume atom didominasi ruang kosong. |
| Muatan positif di inti | Hanya inti yang bermuatan positif. |
| Penjelasan hamburan alfa | Model sesuai hasil eksperimen foil emas. |
Pengaruh Model Atom Rutherford pada Perkembangan Ilmu Pengetahuan
Model atom Rutherford menjadi dasar untuk model atom selanjutnya, terutama model Niels Bohr yang memperkenalkan tingkat energi elektron, dan teori atom kuantum yang dikembangkan lebih lanjut pada abad ke-20. Temuan Rutherford telah membuka wawasan baru dalam fisika nuklir, kimia atom, serta teknologi modern seperti reaktor nuklir dan teknologi medis.
Model atom Rutherford merupakan tonggak revolusioner dalam ilmu kimia dan fisika, karena memperkenalkan konsep inti atom yang bermuatan positif dan elektron yang mengelilinginya dalam ruang yang sebagian besar kosong. Walaupun memiliki kekurangan, ciri-ciri atom Rutherford tetap menjadi dasar penting bagi pemahaman struktur atom modern. Dengan mengetahui sejarah dan ciri-cirinya, kita dapat lebih mengapresiasi perkembangan ilmu pengetahuan yang mempengaruhi teknologi dan kehidupan manusia hingga saat ini.